Wildes Wachstum
Am Anfang ist Krebs nichts anderes als eine „normale“ Körperzelle, allerdings eine, die außer Kontrolle gerät. Wie kann es dazu kommen? Jeder Organismus hat schließlich komplexe Steuerungsmechanismen, die jeder Zelle ihre Rolle im Verbund zuweisen. Doch es gibt viele Arten, auf die die molekularen Sicherungssysteme versagen. LMU-Forscher verfolgen vielfältige Ansätze, um die Fehler, die die Entwicklung von Tumoren begünstigen, aufzudecken und ihnen etwas entgegenzusetzen. So untersuchen sie, wie das Krebswachstum den Gesetzen der Evolution gehorcht. Sie zeigen an einem aggressiven Knochenkrebs, wie zufällige Treibermutationen dafür sorgen, dass das Verhängnis seinen Lauf nimmt. Sie analysieren, wie Tumorzellen dem Immunsystem entkommen, und entwickeln Strategien, es wieder scharfzumachen. Und sie entwickeln besonders treffsichere Formen der Bestrahlung.
Quelle: Artikel erschienen in Einsichten: Das Forschungsmagazin Nummer 1 / 2018 (Text von Hubert Filser, Fotos von Judith Glaubitz)
Abhängig vom Zufall
 Maligne Pünktchen: Zellen eines Ewing-Sarkoms. (Foto: Judith Glaubitz)
Maligne Pünktchen: Zellen eines Ewing-Sarkoms. (Foto: Judith Glaubitz)
Abhängig vom Zufall
Ewing-Sarkom: Erst eine zusätzliche Treibermutation bringt die genetischen Risiken zum Tragen.
Von außen wirkt alles normal. Doch im Inneren der Knochen wuchert der Tumor, bis er fast schon die Größe einer Faust hat. Erst dann verursacht er Schmerzen, die betroffene Jugendliche zunächst eher auf eine Sportverletzung zurückführen. Dass sich in ihrem Inneren Zellen unkontrolliert teilen und zu bösartigen Geschwulsten heranwachsen, ahnen die meisten Betroffenen nicht. Und das alles nur aufgrund einer einzigen Mutation, eines kleinen Drehers im Erbgut, rein zufällig. „Das Ewing-Sarkom ist ein tückischer Krebs“, erklärt LMU-Forscher Thomas Grünewald. „Wir kennen bis heute noch nicht einmal die Anfangszellen.“
Der hochaggressive Knochentumor, der auch im Bindegewebe auftreten kann, betrifft vorwiegend Kinder und Jugendliche, sehr selten Erwachsene. Gerade Jugendliche, sagt der Arzt und Pathologe, haben andere Dinge im Kopf als eine tödliche Krankheit. „Plötzlich werden sie aus ihrer Kindheit gerissen, die Behandlung dauert oft mehr als ein Jahr, viele Jugendliche sind von den Medikamenten später unfruchtbar.“ Diese schlimmen Erfahrungen aus seiner Zeit als Kinderonkologe haben sich dem Münchner Mediziner tief eingeprägt.
Und so begann Grünewald, sich mit dem Ewing-Sarkom später auch als Forscher am Institut für Pathologie der LMU zu beschäftigen. Der US-amerikanische Arzt James Ewing beschrieb den Tumor erstmals im Jahr 1921; auch heute noch verläuft die Erkrankung in einem Drittel der Fälle tödlich. Grünewald sucht gezielt nach genetischen, zellulären und molekularen Auslösern von Knochentumoren, um neue Angriffspunkte für die Therapie zu finden. „Die moderne Pathologie bietet hier perfekte Möglichkeiten“, sagt der Münchner Mediziner, der am Institut für Pathologie eine von der Deutschen Krebshilfe finanzierte Max-Eder-Nachwuchsgruppe leitet. Längst geht es dort nicht mehr nur darum, die Krebszelltypen in Gewebeproben zu identifizieren und den Tumor in seiner Ausdehnung zu lokalisieren. Die Forscher erstellen Genprofile von Krebszellen und verfolgen die Signalwege im Körper der Erkrankten, die zum rasanten Zellwachstum führen.
In seinem Labor sieht Pathologe Grünewald praktisch alle Krebsarten. Als Wissenschaftler habe er sich auch daher auf das Ewing-Sarkom spezialisiert, weil „wir von Krebserkrankungen bei Kindern am meisten über grundlegende Mechanismen der Entstehung und Ausbreitung von Tumoren lernen können“. Krebs bei Kindern sei weniger komplex als bei Erwachsenen, wo er oft von mehreren Mutationen angetrieben wird.
 PD Dr. med. Thomas Grünewald, Ph.D. leitet die Max-Eder-Forschungsgruppe für Pädiatrische Sarkom-Biologie, die von der Deutschen Krebshilfe finanziert wird, und ist Assistenzarzt am Pathologischen Institut der LMU. Grünewald, Jahrgang 1980, studierte Humanmedizin und Philosophie an der Universität Würzburg. Seinen Ph.D. machte Grünewald an der Technischen Universität München, bevor er als Postdoktorand an das Institut Curie nach Paris ging. Im Jahre 2018 habilitierte er sich an der LMU.
PD Dr. med. Thomas Grünewald, Ph.D. leitet die Max-Eder-Forschungsgruppe für Pädiatrische Sarkom-Biologie, die von der Deutschen Krebshilfe finanziert wird, und ist Assistenzarzt am Pathologischen Institut der LMU. Grünewald, Jahrgang 1980, studierte Humanmedizin und Philosophie an der Universität Würzburg. Seinen Ph.D. machte Grünewald an der Technischen Universität München, bevor er als Postdoktorand an das Institut Curie nach Paris ging. Im Jahre 2018 habilitierte er sich an der LMU. Statistische Analysen ergaben, dass Europäer bis zu 20-mal häufiger am Ewing-Sarkom erkranken als Afrikaner. „Das weist darauf hin, welch wichtige Rolle angeborene genetische Varianten im menschlichen Erbgut bei der Tumorentstehung haben“, so Thomas Grünewald. Eine darauf aufbauende genomweite Assoziationsstudie (GWAS) identifizierte zunächst drei Positionen im Erbgut von Europäern, die Betroffene anfälliger für den tückischen Knochen- und Weichteilkrebs machen. Kommt bei Menschen, die so eine angeborene Genvariante in sich tragen, eine spontane Mutation hinzu, beginnt der verheerende Verlauf – so, als würde ein Schalter umgelegt und die einzige, entscheidende Sicherung würde gleichzeitig durchbrennen. Die Wissenschaftler sprechen von einer Treibermutation. Sie macht aus einer Vorstufe ein sogenanntes Onkogen, das die Abhängig vom Zufall Ewing-Sarkom: Erst eine zusätzliche Treibermutation bringt die genetischen Risiken zum Tragen. Zelle zur Tumorzelle werden lässt. Das macht das Ewing-Sarkom so tückisch: Nur ein einzelner Baustein im Körper müsse sich verändern, sagt der Pathologe, damit Krebs entsteht.
Grünewald konnte am Beispiel des Ewing- Sarkoms dieses fatale Zusammenspiel von angeborener Risiko-Variante und zufälliger Mutation zeigen. Der Pathologe geht davon aus, dass ein solches Zusammentreffen in anderen Fällen ebenfalls die Entstehung kindlicher Tumoren begünstigt. „Viele kindliche Tumoren entstehen spontan.“ Eine konkrete Ursache für die entscheidende Mutation beim Ewing-Sarkom scheint es nicht zu geben, zumindest geben Daten keinen Hinweis, dass etwa Lebensumstände oder Umwelteinflüsse eine Rolle spielen könnten. „Es sieht so aus, als sei es schlicht Pech“, sagt Thomas Grünewald. „Es gibt keinen nachvollziehbaren Grund.“
Solche Erkenntnisse könnten Forscher auch verzweifeln lassen. Doch wenn man schon die Entstehung nicht verhindern kann und auch bei der Früherkennung anders als zum Beispiel beim Dickdarmkrebs, bei dem sich harmlose Wucherungen endoskopisch entfernen lassen, keine Möglichkeiten hat, bleibt nur der Ansatz, die mutierten Gene und Transkriptionsfaktoren lückenlos zu identifizieren und dann bei ihrer Arbeit zu stören. Offensichtlich spielen für die genauen Vorgänge die verschiedenen sogenannten Suszeptibilitäts- Loci eine Rolle, also die Orte, an denen die entscheidenden vererbbaren Genvarianten im Erbmaterial auftreten. Drei solcher Regionen auf den Chromosomen 1, 10 und 15 waren bislang bekannt, nun hat Grünewalds Forschergruppe drei weitere Risiko- Regionen auf den Chromosomen 6, 12 und 22 identifiziert. „Das scheint aber nur die sichtbare Spitze des Eisbergs zu sein“, sagt Grünewald. „In dieser Frage werden uns die neuen kostengünstigeren Sequenziertechniken und leistungsstarke Rechner sicher bald weitere Ergebnisse liefern.“
Im nächsten Schritt versuchen die Wissenschaftler im Detail zu verstehen, welche wichtigen Signalwege in den Zellen betroffen sein können, wenn Treibermutation und vererbbare Risikovariante zusammentreffen. Eine fatale Rolle spielt beim Ewing-Sarkom das Gen mit dem Kürzel EGR2, das in den sogenannten FGF-Signalweg eingebunden ist; FGF steht für „fibroblast growth factor“. Im Normalfall re- guliert es in der Embryonalentwicklung die Bildung von Gehirn- und Knochenzellvorläufern mit. Eine der risikoreichen Genvarianten beim Ewing-Sarkom betrifft einen Erbgutabschnitt, der wiederum das Regulatorgen EGR2 steuert. Diese Konstellation wird dann fatal, wenn eine der zufällig auftretenden Treibermutationen dazukommt. EGR2 wird in den Sarkomzellen hochgeregelt, ein längst abgeschaltetes embryonales Zellentwicklungsprogramm wird in der Folge fälschlicherweise wieder angeworfen.
Es sei wichtig, auf lange Sicht all die verschiedenen Mechanismen bei der Entstehung des Krebses zu verstehen, sagt LMUForscher Grünewald. Derzeit untersucht er daher mit seiner Gruppe im Rahmen eines internationalen Forschungsnetzwerks anhand der Gendaten von weltweit bis zu 3000 Ewing-Patienten, allein 300 von ihnen stammen aus Deutschland, was das „Krebs-Genom“ ausmacht.
Ziel seines Projekts ist es, am Beispiel des Ewing-Sarkoms modellhaft zu erforschen, wie angeborene genetische Variabilität im Zusammenspiel mit erworbenen somatischen Mutationen zu jeweils ganz unterschiedlichen klinischen Verläufen führt und wie sich diese Erkenntnisse für eine individualisierte Krebstherapie nutzen lassen.
Hinter jeder Variablen steckt vermutlich ein leicht anderer Signalweg, jeder Patient ist zudem anders. „Es ist ein gutes Beispiel, wie wichtig personalisierte Medizin ist“, sagt Thomas Grünewald. „Langfristig können die Ergebnisse die Basis für individualisierte Therapien sein.“ Im Gespräch vermittelt der Mediziner Zuversicht, dass der Kampf gegen Krebs nicht länger eine aussichtslose Schlacht ist, selbst bei tückischen Krebsarten. „Unsere klinischen Möglichkeiten beim Ewing-Sarkom sind immer noch eher mittelalterlich.“ Doch der Pathologe ist sich sicher: „In wenigen Jahrzehnten werden wir die meisten Betroffenen heilen können.“
Unter Einfluss
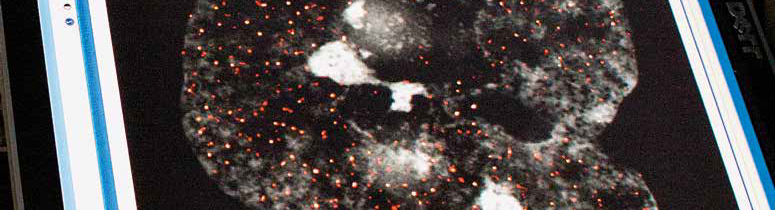 Sogenannte TET-Proteine und ihre Verteilung spielen bei der Tumorentstehung eine wichtige Rolle. Superauflösende Mikroskopie zeigt sie als rote Punkte im Zellkern. (Foto: J. Glaubitz)
Sogenannte TET-Proteine und ihre Verteilung spielen bei der Tumorentstehung eine wichtige Rolle. Superauflösende Mikroskopie zeigt sie als rote Punkte im Zellkern. (Foto: J. Glaubitz)
Unter Einfluss
Der Tumor als Population von Zellen: Welche Rolle spielt Evolution für die Krebserkrankung?
Manchmal sagen Wissenschaftler Sätze, die im ersten Moment nicht so leicht zu verdauen sind. Krebs ist ein unausweichlicher Vorgang im Menschen, ist zum Beispiel so eine Feststellung. „Die Zunahme der Krebshäufigkeit hängt auch damit zusammen, dass wir alle älter werden. Je länger wir leben, desto mehr Mutationen sammeln sich in unserem Körper an“, sagt der Münchner Humanbiologe Heinrich Leonhardt. Ob, wann und warum daraus dann Krebs entsteht, ist oft Zufall. Wie sich die Tumoren im Körper einnisten, wie sie sich ausbreiten und den menschlichen Organismus attackieren, ist im Detail noch nicht genau genug verstanden. Im Rahmen des Sonderforschungsbereichs (SFB) „Genetische und epigenetische Evolution von hämatopoetischen Neoplasien“ untersuchen Münchner Wisenschaftler nun die Mechanismen der Tumorentwicklung im blutbildenden System. Heinrich Leonhardt, der am Biozentrum der LMU arbeitet, ist Sprecher des neuen Verbundes, den die Deutsche Forschungsgemeinschaft (DFG) fördert.
Die Wissenschaftler wählen dabei einen ganz neuen Ansatz und analysieren die Dynamik der Krebserkrankung unter evolutionsbiologischen Aspekten. Der Tumor, so das Bild, ist kein homogenes Gebilde, sondern besteht aus einer heterogenen Population höchst unterschiedlicher Tumorzellen, die den Gesetzen der Evolution unterworfen sind, den gleichen Gesetzmäßigkeiten, wie sie auch Pflanzen- oder Tierpopulationen prägen. Wie jeden Organismus verändert die Evolution auch den Krebs, und mithilfe von Hightech-Genvergleichen lassen sich wichtige Veränderungen im Erbgut der Zellen studieren. „Wir können die Entwicklung einer Krebserkrankung mit den Methoden der Populationsgenetik untersuchen“, sagt Anthropologe und Humangenomiker Wolf- Unter Einfluss Der Tumor als Population von Zellen: Welche Rolle spielt Evolution für die Krebserkrankung? gang Enard vom Biozentrum der LMU, der ebenfalls maßgeblich an dem Großprojekt beteiligt ist.
Wie wichtig die neue Forschungsidee werden könnte, zeigt ein Blick in die Klinik. Viele Mediziner haben erkannt, wie schwer das hochdynamische System Krebs in den Griff zu bekommen ist, weil es sich offenbar immer wieder anpasst. „Es gibt sehr viele, sehr gezielte Krebstherapien“, sagt Heinrich Leonhardt. „Trotzdem kann der Krebs häufig nicht nachhaltig besiegt werden. Wir müssen verstehen, wie der Tumor es schafft, diese eigentlich wirksamen Therapien zu umgehen.“
 Prof. Dr. Wolfgang Enard ist Inhaber des Lehrstuhls für Anthropologie und Humangenomik an der LMU. Enard, Jahrgang 1970, studierte Biologie an der LMU. 1998 wechselte er an das Max-Planck-Institut für Evolutionäre Anthropologie in Leipzig; Promotion 2003, Habilitation 2013. Enard leitete am Leipziger MPI eine eigene Nachwuchsgruppe, bevor er 2013 als Professor nach München kam.
Prof. Dr. Wolfgang Enard ist Inhaber des Lehrstuhls für Anthropologie und Humangenomik an der LMU. Enard, Jahrgang 1970, studierte Biologie an der LMU. 1998 wechselte er an das Max-Planck-Institut für Evolutionäre Anthropologie in Leipzig; Promotion 2003, Habilitation 2013. Enard leitete am Leipziger MPI eine eigene Nachwuchsgruppe, bevor er 2013 als Professor nach München kam. Bereits im Jahr 1976 hatte der Krebsforscher Peter Nowell über das Phänomen nachgedacht, dass Krebs eben nicht gleich Krebs ist. Tumoren entwickeln sich unterschiedlich. Heute ist unter Krebsforschern unstrittig, dass sie den evolutionsbiologischen Aspekt verstehen müssen, wenn sie lernen wollen, die Krankheit in Schach zu halten oder gar zu besiegen. „Krebs ist letzten Endes eine Krankheit des Genoms“, sagt Enard. Es wäre ein Wunder, wenn bei der unvorstellbar großen Zahl von 10 hoch 16 Zellteilungen im Lauf eines menschlichen Lebens nicht auch ein paar Fehler passieren würden. Die allermeisten dieser Mutationen kann die Zellmaschinerie reparieren, bevor sie Schaden anrichten, aber ein paar wichtige – Forscher nennen sie Treibermutationen – sind entscheidend dafür, wie sich eine Krebserkrankung im Körper entwickelt. Diese Evolution der Krebszellen zu verstehen, ist unerlässlich, wenn man im Rennen gegen den Krebs eine Chance haben will. „Je gezielter wir die Therapie auf den jeweiligen Tumor zuschneiden können, umso höher sind die Heilungschancen“, sagt Heinrich Leonhardt.
Im Rahmen des SFB wollen die Forscher in den kommenden Jahren am Beispiel von Tumorerkrankungen des blutbildenden Systems, also an Leukämien und Lymphomen, erforschen, welchen Einfluss Mutation, Selektion und zelluläre Wechselwirkungen auf die Krebsentwicklung haben und welche Rolle evolutionsbiologische Mechanismen insbesondere auch bei Rückfällen nach einer Therapie spielen. Tumorerkrankungen des blutbildenden Systems sind besonders gut geeignet, um die Krebsentstehung zu verfolgen, da intakte Zellen während des Krankheitsverlaufs leichter als bei anderen Krebserkrankungen, etwa von Leber oder Lunge, gewonnen und so detailliert untersucht werden können. Der Münchner Sonderforschungsbereich hat sich auch deshalb den Schwerpunkt Leukämie und Lymphome gewählt, weil an den Universitätkliniken seit mehr als 30 Jahren gezielt Gewebeund Zellproben gesammelt und ausgewertet werden.
Krebszellen müssen einerseits wachsen, sich teilen und vermehren, sich andererseits gegen das Immunsystem und gegen Medikamente verteidigen, um zu überleben. Tumorzellen passen sich an ihre Umgebung an und liefern sich ganz im Sinne der Evolution ein Wettrennen ums Überleben. So erstaunt nicht, was Genetiker bei einer ganzen Reihe von Krebsarten entdecken, wenn sie das Erbgut der jeweiligen Krebszellen mit modernen Hochdurchsatzmaschinen sequenzieren und im Vergleich mit gesundem Gewebe desselben Patienten die Treibermutationen zu lokalisieren versuchen.
Klar ist bislang, dass es offenbar große Unterschiede zwischen einzelnen Krebsarten gibt. „Ein fester Tumor verhält sich sowohl in seiner Entstehung wie in seiner Entwicklung anders als ein liquider Tumor bei der Leukämie“, sagt Leonhardt. Etwa 130 verschiedene Mutationen lassen sich in einem Nierentumor nachweisen, haben Forscher gefunden, nur ein Drittel kam in allen Krebszellen vor, zwei Drittel nur hier und da. „Wir sehen bei Leukämie zwischen drei und sechs wichtige Mutationen in den betroffenen Zellen des blutbildenden Systems“, sagt Leonhardt. Jetzt gilt es herauszufinden, wie diese Mutationen zur Tumorentwicklung beitragen. Dafür müssen die Forscher verstehen, in wie viele Subpopulationen sich ein Krebs aufteilt. Dabei entstehen regelrechte genetische Stammbäume des Tumors. Ein Ziel ist es, auch seltenere, aber möglicherweise aggressivere Untertypen und ihr Verhalten zu erforschen. Diese bleiben im Tumor anfangs oft in der Minderheit, überleben aber die Chemo- oder Strahlentherapie und tragen dann zu einem Rückfall bei. „Der Krebs kommt oft viel aggressiver zurück“, sagt Leonhardt.
 Prof. Dr. Heinrich Leonhardt ist Inhaber des Lehrstuhls für Humanbiologie und Bioimaging an der LMU. Leonhardt, Jahrgang 1961, promovierte im Fach Biochemie an der FU Berlin, war Postdoktorand an der Harvard Medical School in Boston/USA und leitete Nachwuchsgruppen an der Franz-Volhard-Klinik und am Max-Delbrück-Centrum in Berlin-Buch, bevor er 2002 an die LMU kam. Leonhardt ist Sprecher des DFGgeförderten Sonderforschungsbereichs „Genetische und epigenetische Evolution von hämatopoetischen Neoplasien“.
Prof. Dr. Heinrich Leonhardt ist Inhaber des Lehrstuhls für Humanbiologie und Bioimaging an der LMU. Leonhardt, Jahrgang 1961, promovierte im Fach Biochemie an der FU Berlin, war Postdoktorand an der Harvard Medical School in Boston/USA und leitete Nachwuchsgruppen an der Franz-Volhard-Klinik und am Max-Delbrück-Centrum in Berlin-Buch, bevor er 2002 an die LMU kam. Leonhardt ist Sprecher des DFGgeförderten Sonderforschungsbereichs „Genetische und epigenetische Evolution von hämatopoetischen Neoplasien“. Nach Ansicht des Humanbiologen spielt für die Heterogenität in der Entwicklung nicht nur die genetische Evolution der Krebszellen eine Rolle, sondern auch die epigenetische Steuerung der Zellvorgänge. „Vor allem sogenannte DNA-Modifikationen sind bei der epigenetischen Genregulation für die Entwicklung und Ausprägung der Krankheit entscheidend“, sagt Leonhardt.
Solche Modifikationen, etwa kleine angehängte Molekülreste wie Methylgruppen, markieren bestimmte Positionen in der Abfolge der DNA-Bausteine im Genom. Auf dieses Markierungsmuster reagiert die Zellmaschinerie. Damit ist über den eigentlichen genetischen Code gleichsam ein zweiter Steuerungscode gelegt. „Über solche epigenetischen Veränderungen bei der Evolution von Leukämie wissen wir sehr wenig“, sagt Leonhardt.
Mit epigenetischen Veränderungen können Zellen sehr schnell auf ihre Umwelt reagieren, sie machen auch Tumorzellen gewissermaßen flexibler. Wenn beispielsweise bei einem Gen die Methylierung, das Muster der Methylgruppen also, verändert ist, kann sich das auf das Wachstum auswirken. „Solche epigenetischen Signale kontrollieren quasi Gaspedal und Bremse bei Wachstumsprozessen, so dass epigenetische Veränderungen die Balance kippen und Tumorzellen schneller wachsen können“, sagt Heinrich Leonhardt.
Letztlich geht es bei der epigenetischen Steuerung auch um Fragen, die die Identität einer Zelle betreffen. „Bei vielen Tumoren ist die Maschinerie verändert, die die Zellidentität erhält“, so Leonhardt. Eine Zelle weiß dann sozusagen nicht mehr, welche Aufgabe sie hat. Ist die epigenetische Programmierung gestört, führt dies zu einem Funktionsverlust einer Zelle in einem Organ oder im Blut. Zellen werden anfälliger für Fehler und Mutationen, das Krebsrisiko kann auch auf diesem Weg steigen. Möglicherweise, sagt der Humanbiologe, haben manche Krebsarten auch eine epigenetische Ursache.
Bei all den Analysen, die die Wissenschaftler im SFB machen, etwa beim Sequenzieren des Erbguts verschiedener Tumorzellen, entstehen enorme Datenmengen. Das Erbgut jeder Zelle besteht aus drei Milliarden Basenpaaren vom Vater und drei Milliarden Basenpaaren von der Mutter. Jeder Mensch, jeder Tumor ist zudem anders. Das erfordert den Einsatz von Spezialisten zur Auswertung der Daten. Im SFB arbeiten deshalb nicht nur Genetiker, Mediziner und Evolutionsbiologen, sondern auch zahlreiche Mathematiker und Bioinformatiker.
Ziel der Strategie ist es, Modelle für die regulatorischen Prozesse zu erarbeiten und dann auch im Tiermodell intensiv zu untersuchen. Die Forscher wollen so vorausahnen lernen, wie sich ein Krebs verändern und weiter entwickeln könnte, um etwa mit T-Zell-gestützten Immuntherapien einen Tumor gezielt in Schach zu halten. Er soll in keiner noch so kleinen Nische überleben können.
„Die Medizin denkt dafür immer noch zu deterministisch“, sagt Wolfgang Enard. Sein Kollege Heinrich Leonhardt ergänzt: „Wir wollen in der Lage sein, nicht nur den nächsten, sondern mehrere Schritte vorhersehen zu können. Das ist wie beim Schachspiel: Man muss seinen Gegner und dessen System kennenlernen und mindestens immer einen Schritt voraus sein.“ Erfolgversprechend könnten hier in Zukunft Kombinationstherapien mit mehreren Wirkstoffen sein.
Vielleicht müssen die Mediziner auch lernen, dass immer ein paar Tumorzellen übrig bleiben. Vielleicht ist auch eine allzu aggressive Therapie nicht optimal, bei der dann gerade wenige aggressive Tumorzellen überleben. „Es gibt keine hundertprozentige Verdrängung eines Tumors“, sagt Heinrich Leonhardt. „Womöglich ist es besser, wenn das Immunsystem die verbleibenden Zellen in Schach hält.“
Ein Ziel sei es deshalb auch, sagt Wolfgang Enard, mit neuen Erkenntnissen über besonders tückische Krebsarten wie die akute myeloische Leukämie die Therapien besser steuern zu lernen. Eine wichtige Rolle spielt es hierbei auch, das Immunsystem zu stärken. Denn Mutationen werden mit zunehmendem Alter immer häufiger im Genom auftreten, und ein intaktes Immunsystem ist hier der beste grundlegende Schutz, den der Körper dem Krebs entgegenzusetzen hat.
Hilfe zur Selbsthilfe
Hilfe zur Selbsthilfe
Die Immuntherapie setzt das Abwehrsystem des Körpers auf den Krebs an.
 Was kann das Immunsystem gegen Tumorzellen ausrichten? Vorbereitung von Labortests. (Foto: Judith Glaubitz)
Was kann das Immunsystem gegen Tumorzellen ausrichten? Vorbereitung von Labortests. (Foto: Judith Glaubitz) Als William Coley im Jahre 1890 Streptokokken als Heilmittel gegen bereits weit fortgeschrittene Krebsgeschwüre einsetzte, sprach noch niemand von Immuntherapie. Der US-amerikanische Chirurg hatte eher zufällig festgestellt, dass sich der Zustand von Patienten mit Weichteilkrebs plötzlich besserte, wenn sie in Betten lagen, in denen zuvor Menschen mit schweren bakteriellen Infektionen der Haut behandelt worden waren. Coley war damals nicht klar, wie die Methode wirkte, dass nämlich tatsächlich Bakterienextrakte die Körperabwehr anregten. Doch genau genommen war damit die Idee in der Welt, das Immunsystem gegen Tumoren in Stellung zu bringen. Diese Ergebnisse ließen sich aber von anderen Ärzten nicht reproduzieren, wohl auch deshalb nicht, weil die Bakterienstämme nur ungenau standardisiert waren. So geriet Coleys Idee wieder in Vergessenheit.
Erst mehr als hundert Jahre später lenkte ein Zufall den Fokus der Krebsforscher im Zusammenhang mit AIDS wieder auf das Immunsystem. Das tückische HI-Virus hatte die Körperabwehr extrem geschwächt, die Betroffenen starben nicht am Virus selbst, sondern beispielsweise an aggressiven Tumoren. Das Kaposi-Sarkom etwa kam mehr als 200-mal so häufig vor wie beim Rest der Bevölkerung. HIV steigerte offensichtlich das Krebsrisiko. Forscher erkannten, dass das Immunsystem eine Schlüsselrolle bei der Ausbreitung von Krebs spielt und Immun- und Tumorzellen wohl miteinander interagieren. „Das war ein Durchbruch in Richtung klinischer Anwendung von Immuntherapien“, sagt Sebastian Kobold, Leiter der Arbeitsgruppe Immunpharmakologie am Klinikum der LMU. Und so kam in den 1990er-Jahren die Idee wieder auf, beispielsweise weiße Blutkörperchen oder T-Zellen zu stärken Hilfe zur Selbsthilfe Die Immuntherapie setzt das Abwehrsystem des Körpers auf den Krebs an. und gegen bestimmte Tumoren zu richten. Kobold selbst forscht heute an der LMU an Konzepten, wie sich T-Zellen des Immunsystems mithilfe gentechnischer Veränderungen gegen Tumorzellen ausrichten lassen. Dafür hat der Mediziner jüngst einen hochdotierten Starting Grant des Europäischen Forschungsrates (ERC) bekommen. Eine Immuntherapie zielt im Gegensatz zu Chemo- oder Strahlentherapie nicht unmittelbar auf den Tumor; sie soll das körpereigene Immunsystem der Erkrankten so aktivieren, dass es den Tumor bekämpfen kann. „Man muss Krebszellen also nicht mehr direkt ansteuern, um sie abzutöten“, sagt Sebastian Kobold. „Das ist ein ungeheurer Vorteil – und ein Paradigmenwechsel.“ In den USA ist im letzten Jahr erstmals in der Medizingeschichte eine Therapie zugelassen worden, die körpereigene T-Zellen als Medikament gegen akute lymphatische Leukämie und eine Spezialform des Non-Hodgkin-Lymphoms nutzt. Die Fortschritte hängen auch damit zusammen, dass Forscher mittlerweile den Verlauf einer Krebserkrankung besser verstehen und so Ansatzpunkte für gezielte Angriffe erkennen. Krebs beginnt in der Regel mit einer einfachen Mutation in einer einzigen Zelle, Auslöser können eine hohe UV-Strahlung, Zellgifte oder Gendefekte sein. Prinzipiell ist der Organismus in der Lage, dabei entstehende Schäden zu reparieren oder im Notfall die Zelle in den programmierten Zelltod zu treiben und so zu eliminieren. Allerdings können Zellen Mutationen auch ansammeln und dann entarten. Meist bricht der Krebs danach aber noch nicht sofort aus. Im Körper stellt sich zunächst für einige Zeit eine Art Gleichgewicht ein. Während das Immunsystem die Krebszellen eliminieren möchte, versuchen diese, sich schnell zu teilen. Wer hier gewinnt, hängt schlicht davon ab, wer auf Dauer schneller ist. „Der Krebs wird erst dann manifest, wenn er dem Immunsystem entkommt und gelernt hat, es gezielt zu blockieren oder umzuformen“, sagt Kobold. „Das ist der echte Point of no Return.“
 PD Dr. med. Sebastian Kobold ist Leiter der Arbeitsgruppe Immunpharmakologie und Oberarzt am Klinikum der LMU. Kobold, Jahrgang 1983, studierte Medizin in Homburg/Saar, Zürich und Bordeaux. Seine klinische Weiterbildung in Hämatologie und Onkologie sowie Klinischer Pharmakologie absolvierte er am Universitätsklinikum Hamburg-Eppendorf und am Klinikum der LMU. In München baute er zudem eine Arbeitsgruppe in der Abteilung für Klinische Pharmakologie auf. Kobold war Visiting Scientist am Dana Faber Cancer Institute in Boston, USA, und habilitierte sich 2014 an der LMU. 2016 zeichnete ihn der Europäische Forschungsrat (ERC) mit einem seiner hochdotierten Starting Grants aus.
PD Dr. med. Sebastian Kobold ist Leiter der Arbeitsgruppe Immunpharmakologie und Oberarzt am Klinikum der LMU. Kobold, Jahrgang 1983, studierte Medizin in Homburg/Saar, Zürich und Bordeaux. Seine klinische Weiterbildung in Hämatologie und Onkologie sowie Klinischer Pharmakologie absolvierte er am Universitätsklinikum Hamburg-Eppendorf und am Klinikum der LMU. In München baute er zudem eine Arbeitsgruppe in der Abteilung für Klinische Pharmakologie auf. Kobold war Visiting Scientist am Dana Faber Cancer Institute in Boston, USA, und habilitierte sich 2014 an der LMU. 2016 zeichnete ihn der Europäische Forschungsrat (ERC) mit einem seiner hochdotierten Starting Grants aus.Kobold, der einige Jahre selbst als Krebsarzt gearbeitet hat, erforscht im Rahmen seines ERC-Projektes „Armor-T“ vor allem die Immunologie von Bauchspeicheldrüsenkrebs, einem besonders aggressiven Tumor. Bislang entwickelte Immuntherapien, die gegen andere Krebsarten wirken, sind beim Pankreas-Krebs wenig erfolgreich. Warum Bauchspeicheldrüsenkrebs sehr selten heilbar ist, ist bislang nicht vollständig geklärt. Sebastian Kobold will nun T-Zellen therapeutisch einsetzen, es seien schon an sich effiziente Waffen gegen Krebs, die jedoch „irgendwann versagen“. Der Krebs legt sie lahm, wenn er sich ausbreitet.
„Indem wir die Zellen gentechnisch verändern, Rezeptoren oder eigens entwickelte Proteine einbauen, die Krebszellen wiedererkennen können, machen wir sie wieder scharf“, erklärt Kobold. So wollen die Forscher das Immunsystem des Patienten erneut in die Lage versetzen, die Tumorzellen auszuschalten. Es ist ein Kampf, bei dem das Immunsystem schneller als die Krebszellen sein und diese immer wieder austricksen muss. Denn der Krebs hat eine Art Festung um sich herum aufgebaut, sagt Sebastian Kobold, die es zu überwinden gilt.
Getestet werden diese innovativen Therapien zunächst in Modellen, dann in klinischen Studien an Patienten, bei denen die Krankheit weit fortgeschritten ist. „Die Medizin verdankt diesen Menschen viel“, sagt Kobold. „Die Forschung lernt gerade von den schweren Fällen.“ Seine Gruppe hat inzwischen reichlich Erfahrung darin, T-Zellen effizient zu verändern und etwa RNA- oder DNA-Bruchstücke einzubauen, die Botenstoffe oder Krebszellen direkt erkennen können. Weil die Immuntherapie nicht organspezifisch ist, lassen sich die Forschungsergebnisse auf andere Tumorerkrankungen übertragen.
So ist der Arzt verhalten optimistisch, was die Behandlung auch tückischer Krebsarten angeht. Die Zukunft gehöre eindeutig den Kombinationstherapien, sagt Kobold. Klassische Strahlen- oder Chemotherapien werden durch Immuntherapien mit T-Zellen oder sogenannten Checkpoint- Inhibitoren ergänzt. Auch diese Strategie gegen den Krebs muss darauf ausgerichtet sein, das Abwehrbollwerk des Tumors zu überlisten. Tumorzellen wirken nämlich auf das Immunsystem ein, so dass es nicht mehr in der Lage ist, sie zu erkennen. Checkpoint-Inhibitoren wiederum blockieren die Moleküle der Tumorzellen, die die „Blindheit“ auslösen; das Immunsystem kann wieder aktiv werden. „Viele Tumoren haben nicht nur allein einen Wirkmechanismus“, sagt Kobold. „Es ist eine Sisyphos- Arbeit, oft frustrierend, aber wir können wenigstens immer wieder einzelnen Patienten helfen.“
Oft bremsen auch Studien allzu große Erwartungen. Der Antikörper Ipilimumab etwa wirkt nur bei rund einem Fünftel der Patienten. Und das gegen den Schwarzen Hautkrebs aktivierte Immunsystem schafft an anderer Stelle große Probleme. Forscher berichten von chronischen Entzündungen im Darm oder Leberversagen. Kobold betont dennoch die Fortschritte der Immuntherapie. „Jahrzehntelang konnte man für viele Patienten wenig oder nichts tun, jetzt haben wir immer mehr neue Möglichkeiten.“
Wie sehr die Medizin nach zahllosen Rückschlägen auf die Immuntherapie setzt, zeigen auch die Zahlen. Mehr als 30 Zielstrukturen auf Krebszellen selbst oder auf den T-Zellen stehen im Fokus; an sie können Antikörper binden und entweder die Krebszellen in Schach halten oder aber das Immunsystem gezielt zur Abwehr anregen. Derzeit werden mehr als 900 verschiedene Wirkstoffe in über 3000 klinischen Studien untersucht, an den Tests nehmen weltweit rund eine halbe Million Krebspatienten teil. Auch diese beeindruckenden Zahlen sind für Krebsforscher Kobold ein Zeichen der Hoffnung.
Auf den Punkt
Auf den Punkt
Strahlen, die nur den Tumor treffen: Wie die Therapie effizienter und zugleich schonender werden soll.
 Im Reinraum: Zusammenbau eines mikrostrukturierten Gasdetektors für die Bildgebung mit Protonen. (Foto: J. Glaubitz)
Im Reinraum: Zusammenbau eines mikrostrukturierten Gasdetektors für die Bildgebung mit Protonen. (Foto: J. Glaubitz) Wer Katia Parodi zu ihrer Forschung befragt, muss damit rechnen, dass die italienische Physikerin bald freundlich um einen Stift bittet und dann Kurve um Kurve auf den Notizblock zeichnet. Die Skizzen zeigen dann beispielsweise, wie geladene Teilchen, wenn sie Körpergewebe durchdringen, zunächst wenig und in einer gewissen Tiefe schlagartig sehr viel Energie an ihre Umgebung abgeben. Dieser sogenannte Bragg-Peak, den Katia Parodi da erläutert, ist eine Art Trumpf der Physiker im Kampf gegen verschiedenste Krebsarten.
Tumorzellen lassen sich, so die Idee, relativ punktgenau mit einer maximalen Strahlendosis attackieren. Die Methode ist jedoch nicht ohne Nebenwirkungen: Weil energiereiche Strahlung generell Körperzellen zerstört, müssen die Mediziner in der Praxis darauf achten, dass die Strahlendosis möglichst kein gesundes Gewebe schädigt. Genau darum geht es in Katia Parodis Forschungsschwerpunkt: Gemeinsam mit ihren inzwischen 60 Mitarbeitenden am Lehrstuhl für Medizinische Physik der LMU will sie die hochpräzise Strahlentherapie mit Protonen und Photonen verbessern und Ärzten helfen, den Einsatz ihrer Strahlenkanonen auch live über bildgebende Verfahren mitzuverfolgen. „Strahlentherapie ist Millimeterarbeit“, sagt die Münchner Physikerin.
Jahr für Jahr wird allein in Deutschland eine halbe Million neuer Krebserkrankungen diagnostiziert, Tendenz steigend. Jeder dritte Todesfall in westlichen Ländern ist auf Krebs zurückzuführen. Die Radioonkologie ist neben der Chirurgie und der medikamentösen Chemotherapie die dritte Säule der Krebsbehandlung, etwa jeder zweite Krebspatient erhält im Verlauf der Erkrankung eine Strahlentherapie. Sie hat indes den großen Vorteil, weniger invasiv zu sein als andere Therapieformen. Tiefliegende Tumoren oder Geschwüre nahe an lebenswichtigen Organen mit der richtigen Strahlendosis zu erreichen, ist jedoch eine ungeheuer komplexe Aufgabe – und sie stellt sich bei jedem Patienten anders.
Derzeit verwenden Mediziner in neun von zehn Fällen energiereiche Photonen, also Röntgenstrahlung, um Krebszellen zu zerstören. Allerdings geben die Photonen mit zunehmender Tiefe exponentiell immer weniger Energie ab – und belasten auch das dazwischenliegende Gewebe. Elektronen, die sich ebenfalls therapeutisch einsetzen lassen, können nicht tief in den Körper eindringen, sie sind für Haut- oder Brustkrebs geeignet.
Katia Parodi forscht an ihrem Lehrstuhl vor allem an Methoden, die die Protonentherapie verbessern. Energiereiche Protonen oder auch schwerere Ionen wie Kohlenstoff- Ionen haben den großen Vorteil, dass sie das vor einem Tumor liegende Gewebe kaum oder nur minimal schädigen. Die Protonen geben die meiste Energie am Ende ihres Weges ab, wenn sie nach und nach immer langsamer werden. Dieser Bragg-Peak, eine schlagartige Energieabgabe, ist für die Strahlentherapie in der Krebsforschung extrem interessant, da sich die Strahlendosis damit sehr viel gezielter einsetzen lässt, erklärt Parodi. Strahlung ist für das Erbgut jeder Zelle verheerend, daher ist es so wichtig, möglichst ausschließlich Krebszellen zu schädigen. Die Strahlung setzt Brüche in den DNA-Strängen, die Erbinformation wird zerstört, die Zellen können sich nicht mehr teilen und gehen zugrunde. Protonen oder schwerere Ionen wie Kohlenstoff richten dabei erheblich mehr Schaden an als Photonen, wie sie bei der herkömmlichen Strahlentherapie eingesetzt werden. Umso wichtiger ist es bei der neuen Therapie, die Strahlendosis genau am Zielpunkt abzuliefern. „Sie ist besonders gut geeignet für Tumoren, die sich tief im Körper befinden, vor allem solche, die nahe an lebenswichtigen Organen liegen“, sagt Katia Parodi. Mit dem sogenannten pencil-beam scanning lässt sich ein dünner Strahl über Magnetfelder so steuern, dass er über den Tumor wandert und diesen idealerweise Schicht für Schicht zerstört. Das ist präzise wie ein chirurgischer Eingriff, ohne Skalpell und Narkose.
Die Herausforderungen liegen in den Details der praktischen Umsetzung. Die Physiker müssen dafür sorgen, dass die Strahlung während der gesamten Therapie immer an den richtigen Ort gelangt. An erster Stelle steht hier eine exakte Berechnung der Strahlendosis, also der im Patienten deponierten Energie. „Dafür müssen wir die Struktur und die Eigenschaften des Gewebes kennen“, sagt Katia Parodi. Ein Knochen beispielsweise bremst Protonen oder schwerere Ionen deutlich stärker ab als etwa Lungengewebe. Die Wissenschaftler kennen das Verhalten eines Ionenstrahls in Wasser sehr gut, sie versuchen, jedes Gewebe im Verhältnis zu Wasser zu beschreiben. Katia Parodi und ihre Mitarbeiter entwickeln Techniken und theoretische Modelle, um diese Kalibrierung zu verbessern.
 Prof. Dr. Katia Parodi ist Inhaberin des Lehrstuhls für Medizinische Physik an der Fakultät für Physik der LMU. Parodi, Jahrgang 1975, studierte Physik an der Universität Genua, Italien. Sie wurde an der Universität Dresden promoviert, war Postdoktorandin am Massachusetts General Hospital sowie der Harvard Medical School in Boston und leitete eine Arbeitsgruppe am Heidelberger Ionenstrahl-Therapiezentrum, bevor sie im Jahre 2012 dem Ruf nach München folgte. Im Jahre 2016 zeichnete der Europäische Forschungsrat (ERC) Katia Parodi mit einem seiner hochdotierten Consolidator Grants aus. Seit Januar 2017 ist sie auch Präsidentin der Deutschen Gesellschaft für Medizinische Physik (DGMP) und seit Oktober 2017 Sprecherin des von der DFG geförderten Graduiertenkollegs „Fortgeschrittene Medizinische Physik für bildgeführte Krebstherapie“.
Prof. Dr. Katia Parodi ist Inhaberin des Lehrstuhls für Medizinische Physik an der Fakultät für Physik der LMU. Parodi, Jahrgang 1975, studierte Physik an der Universität Genua, Italien. Sie wurde an der Universität Dresden promoviert, war Postdoktorandin am Massachusetts General Hospital sowie der Harvard Medical School in Boston und leitete eine Arbeitsgruppe am Heidelberger Ionenstrahl-Therapiezentrum, bevor sie im Jahre 2012 dem Ruf nach München folgte. Im Jahre 2016 zeichnete der Europäische Forschungsrat (ERC) Katia Parodi mit einem seiner hochdotierten Consolidator Grants aus. Seit Januar 2017 ist sie auch Präsidentin der Deutschen Gesellschaft für Medizinische Physik (DGMP) und seit Oktober 2017 Sprecherin des von der DFG geförderten Graduiertenkollegs „Fortgeschrittene Medizinische Physik für bildgeführte Krebstherapie“. Die LMU-Physikerin weist auch darauf hin, wie wichtig es dafür ist, die Wirkung von Protonen auf das Gewebe besser zu untersuchen. Dazu dient die Forschungsplattform „SIRMIO“ (Small animal proton Irradiator for Research in Molecular Imageguided radiation-Oncology), die das Wissenschaftlerteam um Katia Parodi gerade entwickelt. Mit ihr sollen sich die Wirkung von Protonen und die Unterschiede zur bisher üblichen Methode der Photonenbestrahlung im Tiermodell untersuchen lassen.
Jeder Patient braucht einen detaillierten, an den jeweiligen Tumor angepassten Strahlentherapieplan. Die behandelnden Ärzte müssen nicht nur die genaue Strahlendosis und den Zielort der Bestrahlung festlegen, sondern auch die Richtung, aus der sie den Tumor attackieren, gerade in kritischen Regionen wie dem Gehirn oder im Bauchraum, wenn andere lebenswichtige und dabei empfindliche Organe wie Herz oder Darm in der Nähe liegen. Ein Behandlungsplan muss damit immer eine Balance herstellen zwischen einer möglichst optimalen Bekämpfung der Krebszellen und der Minimierung möglicher Nebenwirkungen. Katia Parodis Abteilung arbeitet daher daran, die Planung von Bestrahlungen zu verbessern. Dies beinhaltet auch eine Risikobetrachtung, inwieweit die Strahlenbehandlung Zweittumoren verursachen kann.
Bei der eigentlichen Bestrahlung des Patienten kommen weitere Faktoren ins Spiel. Ein Patient kann schließlich während der Behandlung nicht komplett regungslos verharren, er bewegt sich immer ein wenig. Zudem gibt es Tumoren in Organen wie der Lunge, die sich zum Beispiel beim Atmen in ihrer Lage verändern. Darüber hinaus erfolgt die Therapie in bis zu 30 Einzelbestrahlungen. Über diese Zeit hinweg kann der Patient Gewicht verlieren, der Tumor kann schrumpfen und normales Gewebe anschwellen. All diese Veränderungen müssen die Experten erfassen und berücksichtigen, sagt Parodi. Ohne Kontrolle von außen kann ein eigentlich punktgenaues Verfahren sonst schnell zu einem Blindflug durch den Körper werden.
Hier rückt ein weiteres Forschungsfeld Parodis in den Fokus, die Bildgebung für die Strahlentherapie. Dafür nutzen die Wissenschaftler einerseits bereits erprobte Techniken wie CT (Computertomographie) oder MRT (Magnetresonanztomographie). Katia Parodi und ihre Gruppe arbeiten zum Beispiel daran, die eher kontrastarme am Bestrahlungsplatz integrierte CT-Bildgebung, die sogenannte Cone-Beam CT, zu verbessern.
Ein weiteres Projekt in Kooperation mit der Klinik für Strahlentherapie des LMU-Klinikums: Am Campus Großhadern wird demnächst ein sogenannter MR-Linac installiert, ein Hightech-Gerät, das die MRTBildgebung und die Strahlentherapie mit Photonen in einem Gerät vereint. Damit werden Veränderungen im Patienten während der Bestrahlung mit bisher ungekannter Genauigkeit sichtbar. Neben der geplanten Münchner Anlage gibt es in Deutschland aktuell nur zwei weitere dieser Großgeräte, in Heidelberg und Tübingen.
Zum anderen suchen die Forscher am Lehrstuhl für Medizinische Physik nach neuen bildgebenden Verfahren für die Ionenstrahltherapie, die den Therapeuten genau zeigen, wo ihre Strahlen gerade wirksam sind. Prinzipiell lassen sich verschiedene physikalische Phänomene dafür nutzen. So können Protonen und Ionen über verschiedene Wechselwirkungen mit dem Gewebe Gammastrahlung erzeugen, deren Ursprungsort sich wiederum mit der Positronenemissionstomographie (PET) lokalisieren lässt. Eine andere Art der Gammastrahlung, die Prompt Gamma, bietet eine noch schnellere und direktere Nachweismöglichkeit des Therapiestrahls, erfordert allerdings, so sagt Parodi, die Erforschung und Entwicklung neuartiger Detektoren.
Ein weiterer Ansatz, dessen Prinzip erstmals in den 1990er-Jahren demonstriert wurde, nutzt einen anderen physikalischen Effekt aus: Wenn die Ionen lokal ihre Energie abgeben, erhöhen sie dort auch die Temperatur des Gewebes. Dies führt zur Ausdehnung des Gewebes, was wiederum Schallwellen auslöst. Verfolgt man diese akustischen Wellen mit mehreren Ultraschallsensoren, lässt sich die Quelle lokalisieren und damit sehen, wo genau der Protonenstrahl das Tumorgewebe attackiert und ob das zu den vorherigen Berechnungen passt. Ideal ist die Methode in weichem und nicht zu tief liegendem Gewebe wie dem der Leber oder der Prostata, weil die Ultraschallwellen hier nicht zu stark absorbiert werden.
Noch gibt es weltweit nur rund 70 Protonenzentren, was auch am hohen technischen Aufwand etwa für die Teilchenbeschleuniger liegt. Und lediglich 150.000 Patienten insgesamt konnten bisher so behandelt werden. Die Forscher setzen große Hoffnung in neue Strahlenquellen und bildgebende Verfahren, inklusive neuartiger laserbasierter Methoden für biomedizinische Anwendungen, die die Experten am Münchner Center for Advanced Laser Application (CALA) erforschen, um die Behandlung von Krebs in Zukunft deutlich zu verbessern.
Großen Wert legt Parodi dabei auf Kooperationen unter anderem mit Ärzten und Biologen, um die klinische Relevanz ihrer Forschung sicherzustellen. „Wir haben in München eine außerordentlich gute Zusammenarbeit von Grundlagenforschern mit behandelnden Strahlentherapeuten, Radiologen und Nuklearmedizinern.” Radiotherapie wird nicht nur allein, sondern immer öfter auch in Kombination mit anderen Therapieformen zur Behandlung von Krebs eingesetzt. „So ist es zum Beispiel denkbar, dass wir den Krebs mit Radiotherapie so weit zurückdrängen, dass ihn das Immunsystem möglicherweise mit Unterstützung entsprechender Therapienwieder in den Griff bekommen kann“, erklärt die Physikerin. Das wäre dann wirklich eine punktgenaue Attacke.

